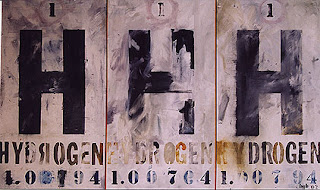quarta-feira, 30 de novembro de 2011
terça-feira, 29 de novembro de 2011
Espuma de Limão
Espuma de Limão - uma sobremesa muito fresca e agradável e que permite ilustrar uma variedade de conceitos científicos.
Nota: O video que tinhamos inicialmente não está já disponível, pelo que o substitimos por um texto.
segunda-feira, 28 de novembro de 2011
domingo, 27 de novembro de 2011
A Química na Arte XXXI
Blair G. Bradshaw
Your Periodic Table, painting, oil on canvas, 50" x 74", 2003
Blair G. Bradshaw
3 Hydrogens, painting, oil on canvas, 36" x 48", 2002
sábado, 26 de novembro de 2011
Química - a nossa Vida, o nosso Futuro
Gostámos tanto deste vídeo de uma jovem estudante - Francesca Morris - que decidimos divulgá-lo aqui.
Esperamos que também goste.
Esperamos que também goste.
Lamentamos mas o vídeo, que era muito interessante, não está mais disponível.
sexta-feira, 25 de novembro de 2011
As importantíssimas ligações de hidrogénio!
A ligação de hidrogénio é uma ligação fraca, mas muito importante. É um tipo de ligação que não ocorre para a formação de moléculas, mas que é responsável pela atracção de diferentes moléculas entre si.
Tal como o nome indica, quando estas ligações se formam estão envolvidos hidrogénios. Mas não serve um hidrogénio qualquer! Têm que ser hidrogénios especiais... Têm que ser hidrogénios que estejam ligados a átomos electronegativos (oxigénio, azoto, flúor...). Como estes átomos são muito electronegativos e são pequenos (estão no topo da tabela periódica) as ligações estão muito polarizadas. Ou seja, o único electrão do hidrogénio é atraído para junto do átomo electronegativo. Não é simpático estes átomos electronegativos já terem tantos electrões e ainda querem o do hidrogénio, pois não? Mas é a nossa sorte!
Consideremos uma molécula de água, como o oxigénio puxa para junto dele os electrões, esta será uma zona da molécula com uma maior densidade de electrões (mais negativa) e os pobre hidrogénios ficam deprovidos de electrões (mais positivos).
Quando um destes hidrogénios se aproxima de um oxigénio de outra molécula de água, é atraído por ela. Estas forças de atracção, de tão importantes, são frequentemente representadas explicitamente para enfatizar a sua força e para isso usam-se ligações a ponteado entre os átomos envolvidos, o que permite distingui-las das ligações covalentes, muito mais fortes, e representadas a cheio.
Estas ligações de hidrogénio têm que ser quebradas para a água passar do estado sólido ao estado líquido e do estado líquido ao estado gasoso, tal explica os altos pontos de fusão e de ebulição da água. São também responsáveis pelo facto do gelo flutuar, como já dissémos e até pela solubilidade do açúcar em água.
As ligação de hidrogénio também desempenham um papel importante na determinação das formas tridimensionais de proteínas. Formam-se entre diferentes partes destas longas moléculas e fazem com que assumam formas específicas que determinar o papel fisiológico ou bioquímico.
São também responsáveis por muitas situações de reconhecimento molecular, e até pela transmissão das características genéticas. É que na divisão celular as nossas moléculas de ADN, têm que ser copiadas, e as ligações de hidrogénio desempenham um papel importante neste processo em que os erros podem ter consequências graves...
quinta-feira, 24 de novembro de 2011
A electronegatividade dos elementos explica muita coisa...
Há tempos alguém que nos lê disse-nos o seguinte:
achei muito legal tudo que li aqui, me ajudou muito, quero saber mais a respeito de ligações de enxofre e pontes de hidrogênio. obrigada.
Vamos pois então falar um pouco mais de ligações de hidrogénio. Mas não hoje… tem mesmo que ficar para amanhã! Antes disso temos que introduzir um conceito muito importante. O conceito de electronegatividade.
Como já aqui temos dito, todas as substâncias são formadas de pequenas partículas chamadas átomos. Cada átomo é constituído por um núcleo, contendo partículas electronicamente neutras, os neutrões, e contendo protões que têm carga positiva.
Em volta do núcleo existem electrões, carregados negativamente, em igual número ao de protões, de modo a que a carga total seja zero. Tal como aqui está representado, de uma forma muito simplificada, para o átomo de carbono.
A electronegatividade mede o poder dos átomos de atrair os seus electrões. Ou, fazendo um paralelismo com outras situações, há átomos que “gostam muito” dos seus electrões e não gostam que eles “vão à vida deles”, de preferência até querem mais e puxam os dos vizinhos para junto deles, e há outros que são um pouco menos "possessivos".
 Linus Pauling desenvolveu uma escala relativa de electronegatividades em que associou aos elementos valores de 0,7 a 4,0, um valor mais alto indicando uma maior força atractiva. Usando esta escala é possível prever que tipo de ligação existe entre dois átomos.
Linus Pauling desenvolveu uma escala relativa de electronegatividades em que associou aos elementos valores de 0,7 a 4,0, um valor mais alto indicando uma maior força atractiva. Usando esta escala é possível prever que tipo de ligação existe entre dois átomos.
Se há uma diferença muito grande de electronegatividades formam-se ligações iónicas, como acontece no sal de cozinha. De facto se há uma diferença suficiente de electronegatividades um dos átomos perde completamente um electrão e forma um catião (fica com uma carga positiva) e o outro átomo recebe esse electrão e forma o anião (fica com uma carga negativa). O catião e o anião, tendo cargas opostas atraiem-se e forma-se uma ligação iónica.
Os átomos que ficam no meio da escala de electronegatividade, não têm tendência a perder ou ganhar electrões, não formam iões e portanto formam ligações covalentes, em que partilham electrões. O mesmo acontece entre átomos que podem estar nos extremos da tabela de electronegatividade, mas têm electronegatividades idênticas. Exemplos de ligações covalentes são o hidrogénio H-H ou a água H-O-H. E as pontes de enxofre, ligação -S-S- de que falámos aqui.
No caso do hidrogénio, o par de electrões é partilhado por dois átomos idênticos os electrões são igualmente partilhados pelos dois átomos.
Contudo se os dois átomos que participam na ligação covalente têm diferentes electronegatividades, ou estão ligados a átomos com diferentes electronegatividades, a partilha é desigual. Isto significa que os electrões estão mais deslocados para o lado do átomo mais electronegativo, ou por outras palavras a ligação está polarizada. É o caso por exemplo de uma ligação C-O ou O-H.
Tudo isto está na base dos comportamentos diferentes das substâncias e na forma como vão interagir entre si. Vai também ser muito útil para compreender o que são e como se formam as ligações de hidrogénio.
(as animações acima foram retiradas DAQUI)
achei muito legal tudo que li aqui, me ajudou muito, quero saber mais a respeito de ligações de enxofre e pontes de hidrogênio. obrigada.
Vamos pois então falar um pouco mais de ligações de hidrogénio. Mas não hoje… tem mesmo que ficar para amanhã! Antes disso temos que introduzir um conceito muito importante. O conceito de electronegatividade.
Como já aqui temos dito, todas as substâncias são formadas de pequenas partículas chamadas átomos. Cada átomo é constituído por um núcleo, contendo partículas electronicamente neutras, os neutrões, e contendo protões que têm carga positiva.
Em volta do núcleo existem electrões, carregados negativamente, em igual número ao de protões, de modo a que a carga total seja zero. Tal como aqui está representado, de uma forma muito simplificada, para o átomo de carbono.
A electronegatividade mede o poder dos átomos de atrair os seus electrões. Ou, fazendo um paralelismo com outras situações, há átomos que “gostam muito” dos seus electrões e não gostam que eles “vão à vida deles”, de preferência até querem mais e puxam os dos vizinhos para junto deles, e há outros que são um pouco menos "possessivos".
 Linus Pauling desenvolveu uma escala relativa de electronegatividades em que associou aos elementos valores de 0,7 a 4,0, um valor mais alto indicando uma maior força atractiva. Usando esta escala é possível prever que tipo de ligação existe entre dois átomos.
Linus Pauling desenvolveu uma escala relativa de electronegatividades em que associou aos elementos valores de 0,7 a 4,0, um valor mais alto indicando uma maior força atractiva. Usando esta escala é possível prever que tipo de ligação existe entre dois átomos. Se há uma diferença muito grande de electronegatividades formam-se ligações iónicas, como acontece no sal de cozinha. De facto se há uma diferença suficiente de electronegatividades um dos átomos perde completamente um electrão e forma um catião (fica com uma carga positiva) e o outro átomo recebe esse electrão e forma o anião (fica com uma carga negativa). O catião e o anião, tendo cargas opostas atraiem-se e forma-se uma ligação iónica.
Os átomos que ficam no meio da escala de electronegatividade, não têm tendência a perder ou ganhar electrões, não formam iões e portanto formam ligações covalentes, em que partilham electrões. O mesmo acontece entre átomos que podem estar nos extremos da tabela de electronegatividade, mas têm electronegatividades idênticas. Exemplos de ligações covalentes são o hidrogénio H-H ou a água H-O-H. E as pontes de enxofre, ligação -S-S- de que falámos aqui.
No caso do hidrogénio, o par de electrões é partilhado por dois átomos idênticos os electrões são igualmente partilhados pelos dois átomos.
Contudo se os dois átomos que participam na ligação covalente têm diferentes electronegatividades, ou estão ligados a átomos com diferentes electronegatividades, a partilha é desigual. Isto significa que os electrões estão mais deslocados para o lado do átomo mais electronegativo, ou por outras palavras a ligação está polarizada. É o caso por exemplo de uma ligação C-O ou O-H.
Tudo isto está na base dos comportamentos diferentes das substâncias e na forma como vão interagir entre si. Vai também ser muito útil para compreender o que são e como se formam as ligações de hidrogénio.
(as animações acima foram retiradas DAQUI)
quarta-feira, 23 de novembro de 2011
A espuma do capuccino...
Um dos nossos leitores deixou-nos aqui há tempos uma questão:
Quando se faz espuma para um capuccino por agitação e não por aquecimento, porque é que a espuma é mais consistente se for com leite magro?
Qual a intervenção dos lípidos neste processo?
Alguém me dá uma dica?
Qual a intervenção dos lípidos neste processo?
Alguém me dá uma dica?
Obrigada pela pergunta! Procurámos alguma informação sobre o assunto e podemos dizer-lhe que, para compreender completamente as razões, ainda há muito trabalho a fazer. É também um assunto que tem despertado interesse dada a grande expansão de casas que vende este tipo de bebidas, inicialmente nos USA e depois um pouco por todo o lado.
Uma espuma deste tipo consiste num gás disperso num líquido. Portanto cada bolha de ar está rodeada de um finíssimo filme de líquido. Tudo o que possa impedir esse líquido de coalescer, libertando o ar, vai permitir que a espuma se forme e vai estabilizá-la.
As proteínas do leite têm um papel importante nisto, não tanto as caseínas (as proteínas que existem em maior quantidade), mas as proteínas do soro do leite. Estas proteínas têm a forma de pequenos novelos que em determinadas situações (por exemplo quando o leite é aquecido acima de 65ºC – na pasteurização ou esterilização) sofrem alterações, desenrolam-se, e vão formar uma rede em torno das bolhas de ar. Vão ainda diminuir a tensão superficial no filme líquido, o que vai dar um tempo de vida maior à espuma. Já falámos destes aspectos a propósito das bolas de sabão.
Tem-se verificado que determinados leites não permitem que se forme uma boa espuma, e que em leites magros as espumas são mais volumosas. Possivelmente haverá alguma influência da gordura propriamente dita. O papel desta nas propriedades estruturais de muitos produtos lácteos ainda não é bem compreendido e a estabilidade de uma espuma contendo partículas de gordura emulsionada pode depender do tamanho e da composição destas partículas. No entanto, há um outro aspecto relacionado com a gordura muito importante, e que pode em grande parte explicar o facto que refere.
Durante o tempo de vida do leite, sobretudo nas primeiras horas, ocorre um processo de lipólise das suas gorduras. Já aqui falámos de gorduras e dissemos que são formadas por uma molécula de glicerol ligadas a três ácidos gordos. Determinadas enzimas, as lipases (que existem naturalmente no leite, ou são produzidas por micro-orgarnismos que contaminam o leite), vão promover o corte das ligações dos ácidos gordos ao glicerol – ou seja, a lipólise. Formam-se ácidos gordos livres e mono e diglicéridos. Estudos feitos demonstram que estes compostos vão influenciar as características das espumas reduzindo o seu volume.
Leites gordos têm mais ácidos gordos livres do que os leites magros, esta pode ser uma das razões para a diferença das características da espuma.
Mas pode haver mais razões, a gordura do leite vai dar-lhe um certo corpo, o leite magro é um leite mais ralo, mais “aguado”. Para lhe dar um pouco de corpo por vezes adicionam ao leite magro proteínas do leite. Um maior teor de proteínas, que estabilizam a espuma, pode contribuir para a formação de uma melhor espuma também. São processos complexos, em que muitos factores intervêm.
Já agora, para concluir, o papel da espuma no capuccino e outras bebidas, além de agradável aos olhos (por vezes são transformadas em verdadeiras obras de arte), é impedir que se forme uma “pele” à superfície e ainda manter a bebida quente, pois as espumas são bons isolantes e retardam a perda do calor.
Subscrever:
Comentários (Atom)